ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Молекулярно-генетическая характеристика трех новых бактериофагов Klebsiella pneumoniae, перспективных для применения в фаговой терапии
Федеральный научно-клинический центр физико-химической медицины Федерального медико-биологического агентства, Москва, Россия
Бактерия Klebsiella pneumoniae способна вызывать широкий спектр внутрибольничных инфекций человека, ассоциированных с антибиотикорезистентностью и высокой смертностью. Одна из перспективных альтернатив применению антибиотиков для лечения таких инфекций — терапия вирулентными бактериофагами. Целью работы было выделить из внешней среды вирулентные бактериофаги, эффективные против актуальных клинических штаммов K. pneumoniae, и дать их молекулярно-генетическую характеристику. Бактериофаги выделяли из проб речной воды методом накопительных культур. Полногеномное секвенирование бактериофагов выполняли на платформе MiSeq (Illumina). Выделено и описано три новых бактериофага K. pneumoniae, принадлежащих к семействам Autographiviridae (vB_KpnP_NER40, GenBank MZ602146) и Myoviridae (vB_KpnM_VIK251, GenBank MZ602147; vB_KpnM_FRZ284, GenBank MZ602148). На коллекции из 105 клинических штаммов K. pneumoniae установлено, что бактериофаги vB_KpnP_NER40 и vB_KpnM_VIK251 обладают узким спектром литической активности (22% и 11%), ограниченным штаммами с капсульным типом К2 и К20 соответственно. Бактериофаг vB_KpnM_FRZ284, напротив, имел широкий спектр литической активности (37%), вызывая лизис штаммов с различным типом капсульного полисахарида. Фаги обладают строго вирулентной природой и не несут в составе генома гены интеграз, токсинов или факторов патогенности. В составе геномов капсулоспецифичных бактериофагов vB_KpnP_NER40 и vB_KpnM_VIK251 обнаружены гены деполимераз, кодирующие потенциальные рецепторсвязывающие белки. Коктейль из трех бактериофагов лизировал около 65% штаммов исследуемой коллекции K. рneumoniae и потенциально применим в терапевтических целях.
Ключевые слова: антибиотикорезистентность, Klebsiella pneumoniae, вирулентные бактериофаги, фаготерапия, деполимераза
Финансирование: исследование выполнено за счет средств, предоставленных для выполнения государственного задания «Разработка персонализированного подхода терапии инфекционных процессов с применением вирулентных бактериофагов» (ШИФР: Бактериофаг).
Благодарности: авторы благодарят Центр высокоточного редактирования и генетических технологий для биомедицины ФГБУ ФНКЦ ФХМ ФМБА России за секвенирование геномов бактериофагов.
Вклад авторов: Р. Б. Городничев, М. А. Корниенко, Е. А. Шитиков — план исследований, обработка данных, написание статьи; Н. С. Купцов — набор и обработка данных, написание статьи; М. В. Малахова, В. А. Веселовский — набор данных; Д. А. Беспятых — обработка данных, Е. Н. Ильина — план исследований, написание статьи.
Соблюдение этических стандартов: вся экспериментальная работа выполнена с соблюдением норм Санитарно-эпидемиологических правил «Безопасность работы с микроорганизмами III–IV групп патогенности (опасности) и возбудителями паразитарных болезней» СП 1.3.2322-08; Санитарно-эпидемиологических правил СП 1.3.2518-09 — «Дополнения и изменения № 1 к санитарно-эпидемиологическим правилам «Безопасность работы с микроорганизмами III–IV групп патогенности (опасности) и возбудителями паразитарных болезней» СП 1.3.2322-08; Санитарноэпидемиологических правил «Санитарно-эпидемиологические требования к обращению с медицинскими отходами» СанПиН 2.1.7.2790-10, а также Федеральных клинических рекомендаций «Рациональное применение бактериофагов в лечебной и противоэпидемической практике».
Для корреспонденции: Роман Борисович Городничев
ул. Малая Пироговская, д. 1а, г. Москва, 119435; moc.liamg@b.r.vehcindorog
Klebsiella pneumoniae — широко распространенная в окружающей среде грамотрицательная неподвижная факультативно анаэробная бактерия. Микроорганизмы этого вида традиционно считают комменсалами, их можно обнаружить на коже человека, в желудочнокишечном и дыхательном трактах [1]. Это второй по распространенности внутрибольничный патоген в мире, способный вызывать широкий спектр инфекций, таких как абсцессы, гнойные раны, септицемия, пневмония, инфекции мочевыводящих путей и желудочно-кишечного тракта [2].
Нерациональное использование антибиотиков в мире привело к возникновению и распространению бактерий с лекарственной устойчивостью. Среди представителей рода Klebsiella наибольшую опасность представляют изоляты, несущие гены бета-лактамаз расширенного спектра действия, или гены карбапенемаз [3]. По данным карты антибиотикорезистентности России, 30–60% нозокомиальных изолятов могут иметь устойчивость к карбапенемам и 60–80% к цефалоспоринам третьего поколения [4].
Вследствие кризиса, вызванного распространением устойчивых форм бактерий, особую актуальность приобретает поиск новых подходов к антимикробной терапии. Одной из перспективных альтернатив является терапия вирулентными бактериофагами (фагами) [5]. Фаги — это естественные антагонисты бактерий в природных популяциях, способные быстро и избирательно лизировать патогены, включая изоляты K. pneumoniae, ассоциированные с устойчивостью к антибиотикам. Бактериофаговую терапию применяют в клинической практике с начала ХХ в., и за всю историю ее использования не было выявлено ни одного значимого побочного эффекта [6]. В настоящее время эффективность и безопасность фаготерапии подтверждены на моделях млекопитающих и Galleria mellonella, а также клинически [7, 8]. Естественным ограничением этого подхода является узкий спектр хозяев отдельных бактериофагов. В этой связи для борьбы с неизвестным патогеном приходится использовать фаговые коктейли, содержащие активные бактериофаги против разных видов бактерий [9].
Диапазон хозяев фагов K. pneumoniae хорошо коррелирует с типом капсульного полисахарида (КПС) [10]. На сегодняшний день описано не менее 130 типов КПС, который является ключевым фактором вирулентности, защищающим бактерии от иммунной системы человека и действия некоторых антибиотиков [11]. Штаммы, характеризующиеся повышенным уровнем экспрессии КПС, часто более вирулентны и относятся к группе гипервирулентных K. pneumoniae [12].
Большинство фагов K. pneumoniae кодируют деполимеразы — ферменты, способные разлагать экзополисахаридную капсулу путем расщепления гликозидных связей [10, 13]. Разнообразие фаговых деполимераз представляет особый интерес, поскольку исследование ферментов может привести к разработке нового класса противомикробных агентов. Показано, что фаговые деполимеразы могут увеличить скорость инактивации бактерий сывороткой in vitro и значительно повысить выживаемость в моделях мышей и личинок Galleria mellonella [14, 15]. Кроме того, фаговые деполимеразы могут быть использованы для быстрого определения типов микробных капсул или разрушения бактериальных биопленок [16].
Целью исследования было провести выделение из внешней среды вирулентных бактериофагов, эффективных против актуальных клинических штаммов K. pneumoniae, дать их описание и оценку перспективности использования в качестве агентов фаговой терапии.
МАТЕРИАЛЫ И МЕТОДЫ
Штаммы бактерий и их характеристика
Коллекция, включающая 105 штаммов K. pneumoniae, была собрана в 2018–2019 гг. на базе Клинической больницы № 123 Федерального научно-клинического центра физикохимической медицины ФМБА России. Все бактерии выращивали в лизогенном бульоне (LB) (Himedia; Индия) при 37 °C. Идентификацию бактерий проводили методом MALDI-TOF масс-спектрометрии, как описано ранее [17]. Чувствительность к антибиотикам определяли дискодиффузионным методом в соответствии с руководством Института клинических и лабораторных стандартов [18].
Молекулярно-генетическая характеристика бактериальных штаммов
Выделение геномной ДНК выполняли с помощью набора «ДНК-экспресс» («Литех»; Россия) в соответствии с инструкцией производителя. Мультилокусное секвенирование-типирование (MLST) штаммов K. pneumoniae проводили путем определения нуклеотидных последовательностей семи генов домашнего хозяйства по стандартной схеме, как описано ранее [19]. Капсульный тип определяли методом секвенирования по Сенгеру гена wzi [20]. Реакцию амплификации генов, входящих в схемы молекулярно-генетического типирования, проводили на TETRAD DNA ENGINE (MJ Research; США). Для секвенирования по Сенгеру использовали прибор 3730 DNA Analyzer (Thermo Fisher Scientific; Великобритания).
Выделение и очистка бактериофагов
Три штамма K. pneumoniae Kp40, Kp25-1 и Kp284 были использованы в качестве хозяев для выделения бактериофагов. Фаги vB_KpnP_NER40, vB_KpnM_VIK251 и vB_KpnM_FRZ284 были выделены из проб воды реки Чермянка по ранее описанному методу [21]. Образец речной воды объемом 15 мл центрифугировали при 10 000 g в течение 15 мин, а супернатант фильтровали с помощью стерильного мембранного шприцевого фильтра 0,22 мкм (Millipore; США). Отфильтрованный супернатант и 0,2 мл культуры штамма-хозяина в фазе логарифмического роста (OD 600 нм = 0,3) добавляли к 15 мл LB-бульона двойной концентрации и инкубировали в течение ночи при перемешивании (200 об./мин) при 37 °C для обогащения фаговой фракции. Далее культуру центрифугировали при 10 000 g в течение 15 мин и затем фильтровали через 0,22 мкм фильтры. Полученные лизаты серийно разводили в LB и определяли титр фага методом агаровых слоев по Грациа для обнаружения и выделения монофагов [22]. Моноизоляты получали последовательным (трехкратным) выделением из отдельных негативных колоний.
Определение спектра литической активности
Спектр литической активности фагов устанавливали методом спот-тестирования с использованием 105 штаммов K. pneumoniae. Аликвоту 100 мкл культуры каждого штамма в фазе логарифмического роста (OD 600 нм = 0,3) добавляли к 5 мл полужидкого агара (0,6%), который затем вносили поверх нижнего агарового слоя. Фаговый лизат объемом 5 мл с титром 106 БОЕ/мл наносили каплями на свежевысеянные газоны штаммов и оставляли высыхать до полного впитывания. Результат оценивали после инкубации в течение ночи при 37 °C по наличию зон лизиса на месте нанесенных капель бактериофага. В случае образования сплошной зоны лизиса или единичных негативных колоний штамм бактерии считали чувствительным к действию бактериофага.
Полногеномное секвенирование бактериофагов и биоинформатический анализ данных
Для выделения тотальной ДНК фагов использовали стандартный протокол фенол-хлороформной экстракции, как описано ранее [23]. Процедуру секвенирования осуществляли с помощью инструмента MiSeq с использованием набора реагентов для секвенирования MiSeq Reagent Nano Kit v2 (500cycle) (Illumina; США) согласно рекомендациям производителя.
Сборку геномов проводили с помощью программы SPAdes (v.3.14.0). Открытые рамки считывания (ОРС) предсказывали с помощью GeneMarkS (версия 4.32), Phast и VGAS. Программные пакеты tRNAScan-SE (University of California Santa Cruz, USA) и ARAGORN (Murdoch University, Australia) использовали для предсказания наличия в геноме транспортной РНК (тРНК). Предполагаемые функции белков, кодируемых отдельными ОРС, были предсказаны вручную с помощью BLASTp, HHPred, Phast и InterPro. Поиск генов токсинов и других факторов вирулентности в геномах бактериофагов осуществляли с использованием баз данных факторов вирулентности патогенных бактерий [24]. Для выявления детерминант устойчивости к антибиотикам проводили сравнение с базой генов устойчивости к антибиотикам [25]. Филогенетический анализ осуществляли с использованием аминокислотных последовательностей РНКполимеразы для фагов семейства Autographiviridae и большой субъединицы терминазы для фагов семейства Myoviridae в соответствии с рекомендациями Международного комитета по таксономии вирусов (МКТВ) (https://talk.ictvonline.org/ taxonomy). Филогенетическое древо было построено с помощью метода дистанционной филогении Genome-BLAST, реализованного в веб-сервере VICTOR.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Выделение и фенотипическая характеристика трех новых фагов Klebsiella pneumoniae
В качестве штамма-хозяина для фага vB_KpnP_NER40 был использован штамм K. pneumoniae Kp40, относящийся к сиквенс-типу (ST) 395 и капсульному типу К2. Штамм K. pneumoniae Kp25-1, принадлежащий к ST268 и капсульному типу К20, использовали в качестве хозяина для выделения бактериофага vB_KpnM_VIK251. Третий штамм K. pneumoniae Kp284, относящийся к редкому сиквенс-типу ST1655 и обладающий неопределенным типом капсулы, был выбран как штамм-хозяин для фага vB_KpnM_FRZ284. Штаммы K. pneumoniae, использованные в качестве хозяев, обладали устойчивостью к трем и более классам антибиотиков, в том числе к меропенему.
Бактериофаг vB_KpnP_NER40 формировал крупные (3–5 мм) негативные колонии, окруженные широким (2–4 мм) ореолом. Негативные колонии фага vB_KpnM_ VIK251 характеризовались меньшим размером (2–3 мм) и были окружены небольшим (1–2 мм) ореолом. Фаг vB_KpnM_FRZ284 формировал мелкие (1–2 мм) негативные колонии без ореола (рис. 1). По литературным данным, наличие полупрозрачного ореола вокруг негативной колонии связано с предполагаемой активностью фаговых деполимераз [26].
Спектр литической активности бактериофагов
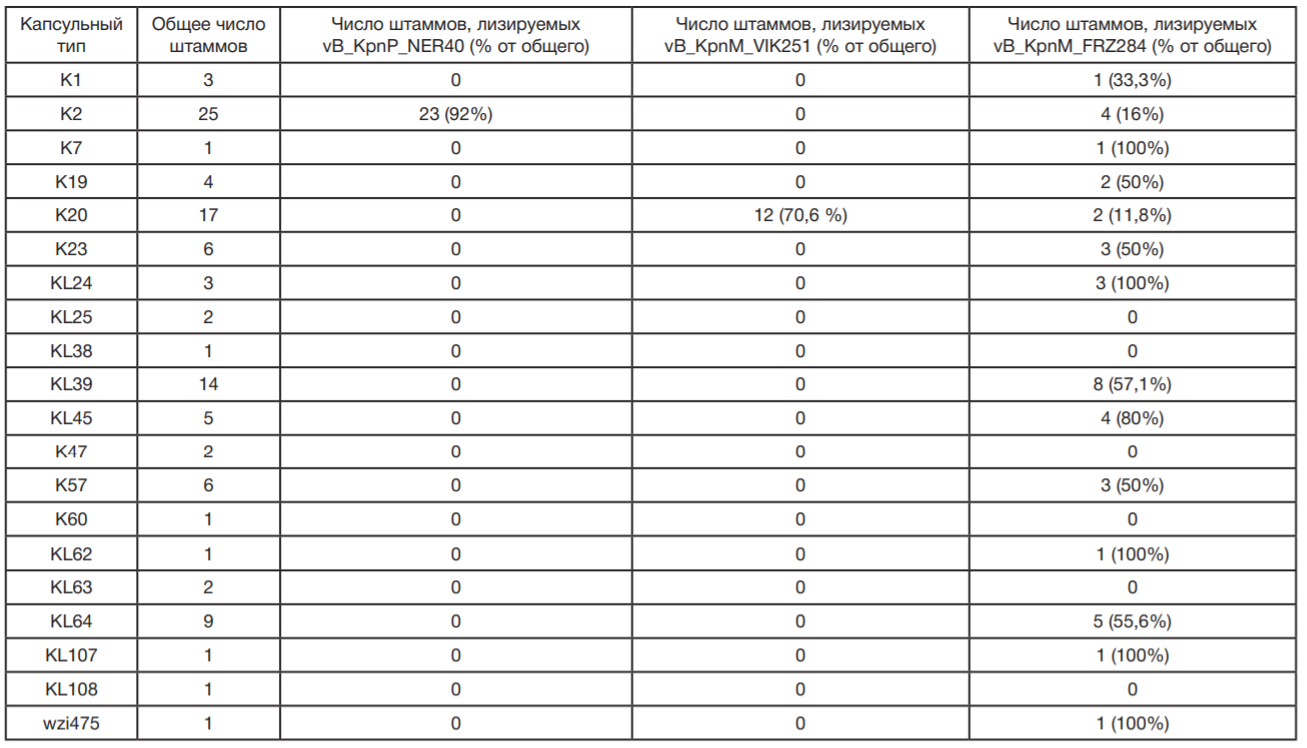
Для определения спектра литической активности исследуемых фагов использовали коллекцию из 105 штаммов K. рneumoniae. По результатам типирования последовательности гена wzi, штаммы K. pneumoniae имели 20 уникальных капсульных типов. Наиболее распространенными капсульными типами были K2 (n = 25; 23,8%), K20 (n = 17; 16,2%), KL39 (n = 14; 13,3%) и KL64 (n = 9; 8,6%).
Бактериофаги vB_KpnP_NER40 и vB_KpnM_VIK251 обладали узким спектром литической активности, ограниченным штаммами с одним капсульным типом (табл. 1). Фаг vB_KpnP_NER40 лизировал 23 из 25 штаммов с капсульным типом К2, а фаг vB_KpnM_VIK251 — 12 из 17 штаммов с капсульным типом К20. Напротив, фаг vB_KpnM_FRZ284 показывал литическую активность, не ограниченную каким-то одним типом капсулы, и лизировал 39 штаммов коллекции 14 различных капсульных типов (табл. 1).
Анализ результатов полногеномного секвенирования бактериофагов
Для бактериофагов vB_KpnP_NER40, vB_KpnM_VIK251 и vB_KpnM_FRZ284 было проведено полногеномное секвенирование с последующим анализом данных. Аннотированные геномные последовательности бактериофагов были депонированы в базе данных NCBI GenBank под номерами MZ602146 (vB_KpnP_NER40), MZ602147 (vB_KpnM_VIK251) и MZ602148 (vB_KpnM_FRZ284).
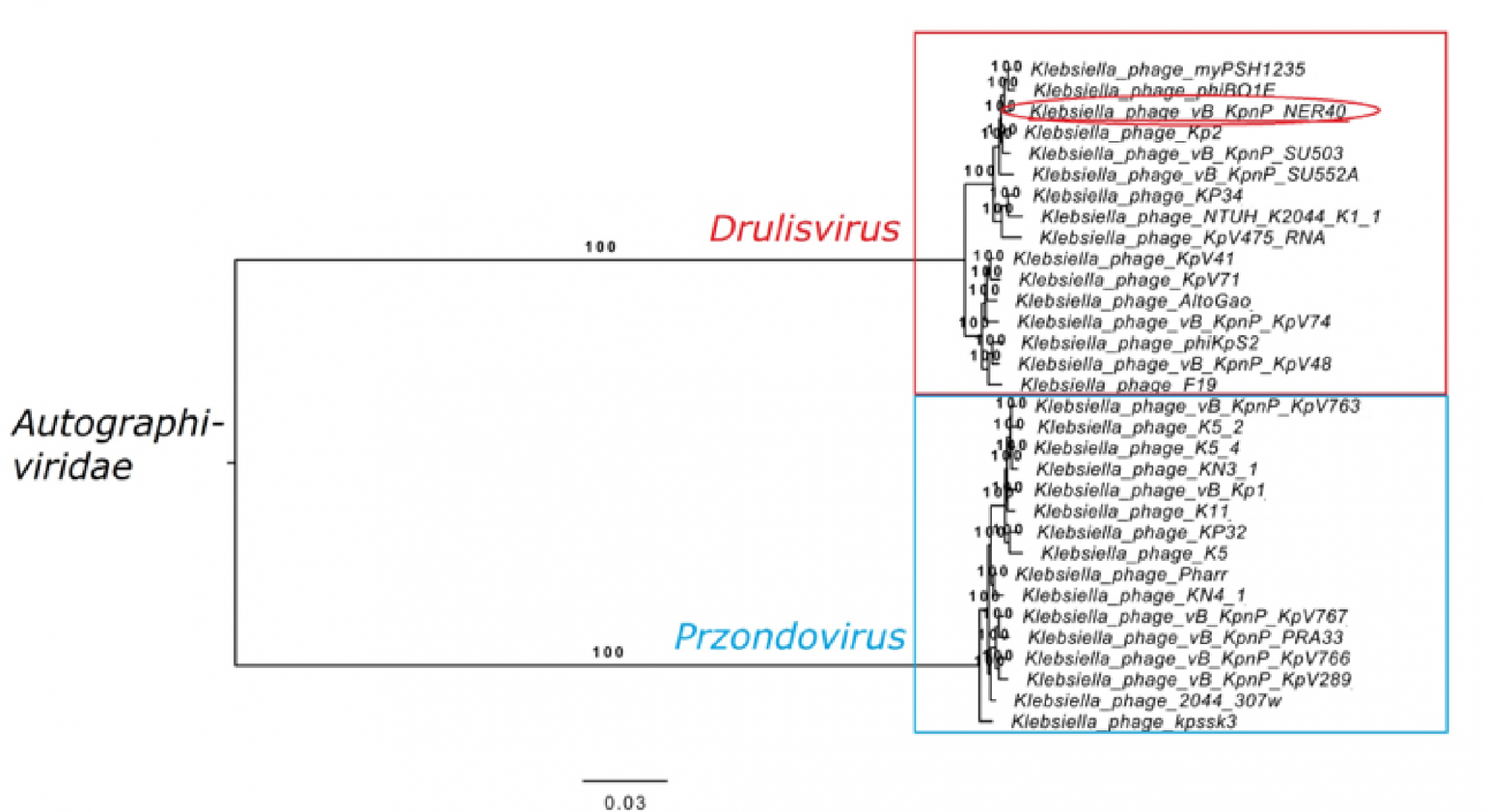
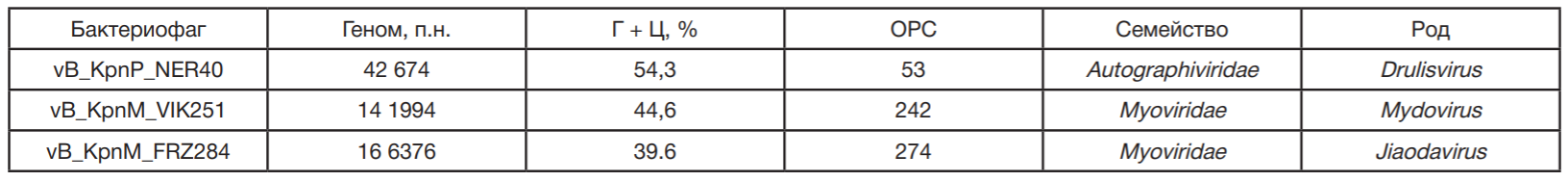
Геном фага vB_KpnP_NER40 был представлен двухцепочечной ДНК и имел длину 42 674 п.н. Содержание пар Г + Ц составило 54,3%. Биоинформационный анализ выявил 53 ОРС общей протяженностью 39 659 п.н. (табл. 2). Анализ нуклеотидной последовательности генома с помощью алгоритма BLASTn показал, что фаг vB_KpnP_ NER40 принадлежит к семейству Autographiviridae. Для верификации филогенетического положения фага было построено филогенетическое древо на основании аминокислотных последовательностей РНК-полимеразы фагов, рекомендованных МКТВ и принадлежащих к семейству Autographiviridae. Согласно филогенетическому анализу, фаг vB_KpnP_NER40 принадлежит к роду
Drulisvirus семейства Autographiviridae и наиболее близок к фагу phiBO1E (GenBank KM576124.1; 87% покрытия и 92,05% идентичности согласно BLASTn) (рис. 2).
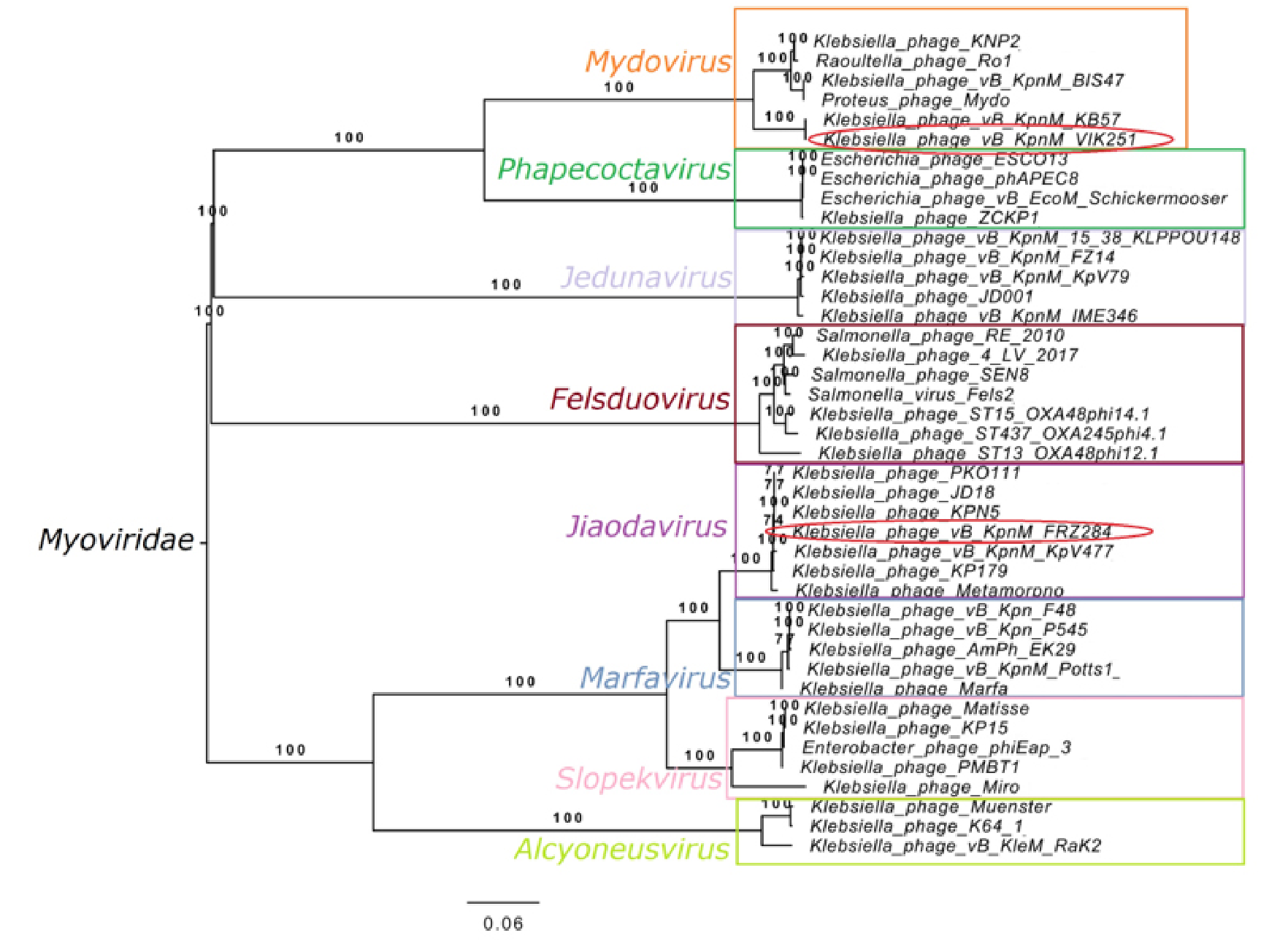
Геном vB_KpnM_VIK251 представлял собой линейную молекулу дцДНК размером 141 994 п.н. с содержанием пар Г + Ц 44,6%. Всего было выявлено 242 открытые рамки считывания и 23 последовательности, кодирующие тРНК. Согласно BLASTn, фаг соответствовал семейству Myoviridae и был близок к представителям рода Mydovirus.
Геном фага vB_KpnM_FRZ284 также был представлен дцДНК и по данным BLASTn относился к семейству Myoviridae, однако был более близок к фагам, принадлежащим к роду Jiaodavirus. Фаг имел длину 166 376 п.н. с содержанием пар Г + Ц 39,6% и кодировал 274 открытых рамки считывания и 16 тРНК (см. табл. 2).
Для уточнения филогенетической позиции фагов Myoviridae было построено древо на основании аминокислотных последовательностей большой субъединицы терминазы фагов vB_KpnM_VIK251 и vB_KpnM_ FRZ284 и фагов, рекомендованных МКТВ (рис. 3). По результатам филогенетического анализа фаг vB_KpnM_ VIK251 относился к роду Mydovirus и наиболее близко располагался к фагу vB_KpnM_KB57 (GenBank KT934943.1; 87% покрытия и 96,71% идентичности согласно BLASTn).
Фаг vB_KpnM_FRZ284 соответствовал фагам семейства Myoviridae, рода Jiaodavirus и был близок к KPN5 (GenBank MN101229.1, 93% покрытия и 97,23% идентичности согласно BLASTn) (см. рис. 3).
Функциональная аннотация фагов K. pneumoniae
В процессе аннотации фага vB_KpnP_NER40 удалось предсказать функцию для 25 белков, кодируемых геномом. vB_KpnP_NER40 имел типичную для Т7-подобных фагов организацию и характеризовался присутствием фаговых ДНК- и РНК-полимераз, а также кассеты лизиса, состоящей из расположенных друг за другом генов, кодирующих спанин, холин и эндолизин [27]. В геноме не было обнаружено ни одного гена тРНК, известных детерминант устойчивости к антибиотикам, интеграз или токсинов.
В геноме фага vB_KpnP_NER40 было закодировано два белка, определяющих хозяйскую специфичность: NER40_00045 и NER40_00053. Первый белок NER40_00045 имеет длину 318 аминокислот и представляет собой высококонсервативный белок для фагов рода Drulisvirus. Второй белок NER40_00053 имеет высокую степень гомологии с хвостовыми фибриллами шести фагов K. pneumoniae (QEQ50388.1, CAD5239035.1, QJI52632.1, YP_009789295.1, YP_009792408.1, YP_009006074.1; 96%-е покрытие и 98,42–97,52% идентичности согласно BLASTp). Более того, данный белок кодирует потенциальный домен пектатлиазы с бета-спиральной структурой, характерной для фаговых деполимераз.
репликации, регуляции, транскрипции и трансляции ДНК, лизис хозяина) может быть присвоена продуктам 145 открытых рамок считывания. Не было обнаружено ни одного гена, функция которого была бы связана с лизогенным жизненным циклом фагов. В составе генома данного фага было обнаружено как минимум два гена (VIK251_00041 и VIK251_00046), кодирующих гомологичные фаговым фибриллам белки.
Бактериофаг vB_KpnM_FRZ284 кодирует 126 белков, которым может быть приписана предполагаемая функция. В составе генома не было обнаружено генов интеграз, токсинов или иных факторов патогенности, исключающих его применение для терапии. Аппарат рецепторсвязывающих белков данного фага представлен четырьмя белками (FRZ284_00009, FRZ284_00012, FRZ284_00098 и FRZ284_00101), имеющими гомологию с известными белками фибрилл фагов рода Jiaodavirus.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Мультирезистентные штаммы K. pneumoniae, принадлежащие к сиквенс-типам 395 и 268 и капсульным типам К2 и К20, были использованы в качестве штаммовхозяев для выделения бактериофагов. Такие изоляты широко распространены и часто связаны с нозокомиальными вспышками, вызванными карбапенемрезистентными и гипервирулентными штаммами в Азии и Европе [28, 29].
В рамках поиска возможных альтернативных антимикробных терапевтических агентов были выделены три новых литических фага K. pneumoniae. Фаги vB_KpnM_VIK251 и vB_KpnM_FRZ284 принадлежат разным родам семейства Myoviridae. Фаг vB_KpnP_ NER40 относится к семейству Autographiviridae. Фаги vB_ KpnP_NER40 и vB_KpnM_VIK251 обладают выраженной капсулоспецифичностью (К2- и К20-специфичностью соответственно) и лизировали 70–90% штаммов, обладающих соответствующим капсульным типом. В свою очередь vB_KpnM_FRZ284 лизировал 36% штаммов коллекции независимо от капсульного типа штаммов.
Бактериофаг vB_KpnP_NER40 кодировал деполимеразу в составе рецепторсвязывающего белка, определяющую хозяйскую специфичность. Деполимераза фага vB_KpnP_ NER40 гомологична нескольким рецепторсвязывающим белкам фагов, в том числе уже описанной деполимеразе фага KpV74 (NC_047811.1, 96%-е покрытие и 98,2% идентичности согласно BLASTp) с К2-специфичностью [14].
При более детальном рассмотрении генома бактериофага vB_KpnM_VIK251 можно заметить, что ген VIK251_00052 кодирует белок с неизвестной функцией, однако N-концевая часть данного белка обладает высокой гомологией с хвостовой фибриллой, несущей рецепторсвязывающий деполимеразный доменом у фага vB_KpnM_Seu621 (QOI68629.1). Остальная часть данного белка кодирует пектатлиазный домен с бета-спиральной структурой, что может говорить о принадлежности данного гипотетического белка к аппарату фаговых фибрилл, ответственных за распознавание хозяйских рецепторов и деполимеразную активность данного фага. Предполагаемая деполимераза фага vB_KpnM_VIK251 не имеет гомологичных белков, содержащихся в базе данных NCBI, что представляет большой интерес в связи с перспективностью деполимераз как возможного терапевтического агента для борьбы с клебсиеллезными инфекциями [15].
Механизм адсорбции третьего фага vB_KpnM_FRZ284 на сегодняшний день не известен, однако широкий спектр литической активности делает его перспективным для дальнейшего исследования в целях возможного биоинженерного расширения спектра литической активности других бактериофагов.
С точки зрения возможностей для терапии инфекционных заболеваний, вызванных K. pneumoniae, следует отметить, что коктейль, составленный из исследуемых фагов, лизирует 65% штаммов коллекции, и это сравнимо с эффективностью коммерческих препаратов бактериофагов, включающих в свой состав несколько десятков бактериофагов [30].
ВЫВОДЫ
Выделенные из природных источников бактериофаги vB_KpnP_NER40, vB_KpnM_VIK251 и vB_KpnM_FRZ284 демонстрируют высокий потенциал в качестве альтернативных антибактериальных агентов против K. pneumoniae, устойчивых к антибиотикам. Строгая хозяйская специфичность фагов vB_KpnM_VIK251 и vB_ KpnP_NER40 и потенциальная способность разрушать капсульные полисахариды, а также широкий спектр литической активности для фага vB_KpnM_FRZ284 делают исследуемые фаги перспективными кандидатами для получения высокоэффективных коктейлей бактериофагов.
- Paczosa MK, Mecsas J. Klebsiella pneumoniae: going on the offense with a strong defense. Microbiology and Molecular Biology Reviews. 2016; 80 (3): 629–61.
- Podschun R, Ullmann U. Klebsiella spp. as nosocomial pathogens: Epidemiology, taxonomy, typing methods, and pathogenicity factors. Clin Microbiol Rev. 1998; 11 (4): 589–603.
- Lee CR, et al. Global dissemination of carbapenemase-producing Klebsiella pneumoniae: epidemiology, genetic context, treatment options, and detection methods. Frontiers in microbiology. 2016; 7: 895.
- Kuzmenkov AY, et al. AMRmap: an interactive web platform for analysis of antimicrobial resistance surveillance data in Russia. Front Microbiol. 2021; 12: 377.
- Górski A, et al. Phage therapy: current status and perspectives. Med Res Rev. 2020; 40 (1): 459–63.
- Payne RJH, Jansen VAA. Phage therapy: the peculiar kinetics of self-replicating pharmaceuticals. Clin Pharmacol Ther. 2000; 68 (3): 225–230.
- Schooley RT, et al. Development and use of personalized bacteriophage-based therapeutic cocktails to treat a patient with a disseminated resistant Acinetobacter baumannii infection. Antimicrob Agents Chemother. 2017; 61 (10): e00954–17.
- Dedrick RM, et al. Engineered bacteriophages for treatment of a patient with a disseminated drug-resistant Mycobacterium abscessus. Nat Med. 2019; 25 (5): 730–3.
- Clark JR, March JB. Bacteriophages and biotechnology: vaccines, gene therapy and antibacterials. Trends Biotechnol. 2006; 24 (5): 212–8.
- Pires DP, et al. Bacteriophage-encoded depolymerases: their diversity and biotechnological applications. Appl Microbiol Biotechnol. 2016; 100 (5): 2141–51.
- Wyres KL, et al. Identification of Klebsiella capsule synthesis loci from whole genome data. Microb genomics. 2016; 2 (12).
- Sobirk SK, Struve C, Jacobsson SG. Primary Klebsiella pneumoniae liver abscess with metastatic spread to lung and eye, a NorthEuropean Case Report of an emerging syndrome. Open Microbiol. 2010; 4 (1): 5–7.
- Knecht LE, Veljkovic M, Fieseler L. Diversity and function of phage encoded depolymerases. Front Microbiol. 2020; 10: 2949.
- Solovieva EV, et al. Comparative genome analysis of novel Podoviruses lytic for hypermucoviscous Klebsiella pneumoniae of K1, K2, and K57 capsular types. Virus Res. 2018; 243: 10–18.
- Volozhantsev N, et al. Characterization and therapeutic potential of Bacteriophage-encoded polysaccharide depolymerases with — galactosidase activity against Klebsiella pneumoniae K57 capsular type. Antibiot. 2020; 9 (11): 1–16.
- Scorpio A, et al. Treatment of experimental anthrax with recombinant capsule depolymerase. Antimicrob Agents Chemother. 2008; 52 (3): 1014.
- Kornienko M, et al. Analysis of nosocomial Staphylococcus haemolyticus by MLST and MALDI-TOF mass spectrometry. Infect Genet Evol. 2016; 39: 99–105.
- M100 Performance Standards for Antimicrobial Susceptibility Testing An informational supplement for global application developed through the Clinical and Laboratory Standards Institute consensus process. 29th ed. Clinical and Laboratory Standards Institute, Wayne, Pennsylvania, 2019. Available from: https://clsi. org/media/2663/m100ed29_sample.pdf.
- Diancourt L, et al. Multilocus sequence typing of Klebsiella pneumoniae nosocomial isolates. J Clin Microbiol. 2005; 43 (8): 4178–82.
- Brisse S, et al. Wzi gene sequencing, a rapid method for determination of capsular type for Klebsiella strains. J Clin Microbiol. 2013; 51 (12): 4073–8.
- Van Twest R, Kropinski AM. Bacteriophage enrichment from water and soil. Methods Mol Biol. 2009; 501: 15–21.
- Mazzocco A, et al. Enumeration of bacteriophages using the small drop plaque assay system. Methods Mol Biol. 2009; 501: 81–85.
- Sambrook J, Fritsch EF, Maniatis T. Molecular cloning: a laboratory manual. 1989; 2.
- Liu B, et al. VFDB 2019: a comparative pathogenomic platform with an interactive web interface. Nucleic Acids Res. 2019; 47 (D1): D687–D692.
- Liu B, Pop M. ARDB — Antibiotic Resistance Genes Database. Nucleic Acids Res. 2009; 37.
- Wang C, et al. Protective and therapeutic application of the depolymerase derived from a novel KN1 genotype of Klebsiella pneumoniae bacteriophage in mice. Res Microbiol. 2019; 170 (3): 156–64.
- D’Andrea MM, et al. φbO1E, a newly discovered lytic bacteriophage targeting carbapenemase-producing Klebsiella pneumoniae of the pandemic Clonal Group 258 clade II lineage. Sci Rep. 2017; 7 (1): 1–8.
- Yang J, et al. A nosocomial outbreak of KPC-2-producing Klebsiella pneumoniae in a Chinese hospital: dissemination of ST11 and emergence of ST37, ST392 and ST395. Clin Microbiol Infect. 2013; 19 (11): E509–E515.
- Muggeo A, et al. Spread of Klebsiella pneumoniae ST395 nonsusceptible to carbapenems and resistant to fluoroquinolones in North-Eastern France. J Glob. 2018; 13: 98–103.
- Купцов Н. С., Корниенко М. А., Городничев Р. Б., Данилов Д. И., Малахова М. В., Парфенова Т. В. и др. Эффективность препаратов бактериофагов против патогенов группы ESKAPE. Вестник РГМУ. 2020; (3): 19–26.