


Тау-белок связывается с микротрубочками зрелого нейрона. Активность тау-белка, способствующая сборке микротрубочек, регулируется степенью его фосфорилирования. Нормальный тау-белок мозга взрослого человека содержит 2–3 моля фосфата на моль тау-белка. При болезни Альцгеймера (БА) тау-белок в три- четыре раза более фосфорилирован, чем нормальный тау-белок и в этом состоянии он полимеризуется в парные спиральные филаменты (PHF), смешанные с прямыми филаментами (SF), образующими нейрофибриллярные клубки, которые, в свою очередь, являются в дальнейшем центрами патологической агрегации для других белковых молекул.
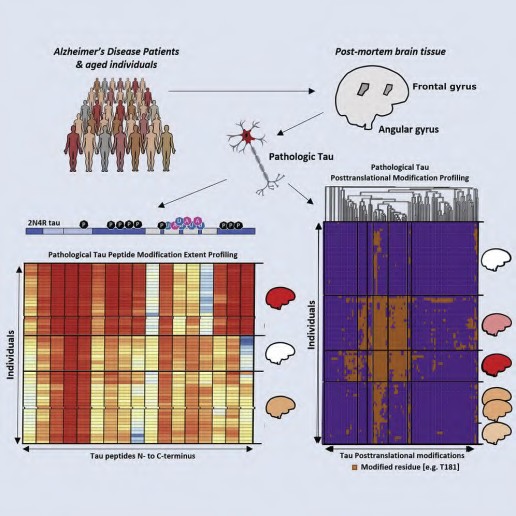
Ученые из США выясняли роль изоформ тау-белка и стехиометрию его посттрансляционных модификаций (ПТМ) на разных стадиях болезни Альцгеймера. Они создали количественную протеомную карту высокого разрешения девяносто пяти ПТМ множества изоформ тау-белка, выделенных из посмертных тканей 49 пациентов и 42 контролей. Хотя карты ПTM свидетельствуют о неоднородности между субъектами, некоторые ПTM указывают на прочную связь с частотой возникновения болезни Альцгеймера, в том числе, ее стадийностью, что указывает на важные молекулярные детерминанты заболевания. Анализ результатов показал, что ПТМ, в основном фосфорилирование остатков серина и треонина тау- белка, происходят упорядоченным образом, а их аккумулирование во времени приводит к появлению аберрантных форм белка склонных к агрегации. Фракционирование по размеру тау-белков в образцах позволило также выявить несколько патологических изоформ. Важность своих исследований ученые видят в том, что существует принципиальная возможность терапевтического вмешательства на разных стадиях заболевания. Этого можно достичь путем воздействия на специфические патогенные изоформы тау-белка, такие как изоформы 0N и 4R, транкированные по С-концу белка, характеризующиеся отрицательным зарядом в богатой пролином области (PRR) и снижением положительного заряда в области связывания микротрубочек (microtubule binding domain), что поможет, в конечном итоге, предотвратить патологическую агрегацию тау-белка с другими белками. С другой стороны, разработка способов селективного ингибирования при аномальном гиперфосфорилировании тау-белка может стать терапевтической тактикой для лечения болезни Альцгеймера и других таупатий.
Данная работа вносит дополнительный вклад в системное понимание молекулярных основ патогенеза болезни Альцгеймера с точки зрения профилирования изоформ тау-белка и его пост- трансляционных модификаций.