


Молекулы, несущие один или несколько электрофильных участков, могут образовывать ковалентные связи с белками, образуя у них новые сайты связывания с белками, с которыми они в естественных условиях не взаимодействуют.
Молекулы, несущие один или несколько электрофильных участков, могут образовывать ковалентные связи с белками, образуя у них новые сайты связывания с белками, с которыми они в естественных условиях не взаимодействуют. Такие молекулы получили название «молекулярный клей». Многие природные соединения могут проявлять свойства "молекулярных клеев". Эти вещества обладают терапевтическим потенциалом, поскольку с их помощью оказывается возможным стабилизировать взаимодействия между белками, которые обычно в природе не взаимодействуют, что позволяет придавать белкам новые свойства и нацеливать их на ту или иную мишень. Свойства таких молекул по- прежнему плохо изучены, а их открытие было случайным. Так, науке известны всего три молекулярных клея: талидамид, рапамицин и дитерпены котиленина.
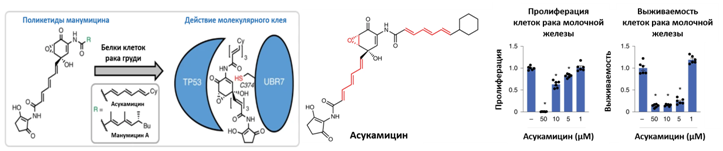
Ученые из США проверили способность двух природных веществ – асукамицина и манумицина, выступать в роли "молекулярного клея" и подавлять рост клеток опухоли тройного негативного рака молочной железы. Любопытно, что и асукамицин, и манумицин имеют природное происхождение и широко представлены в некоторых грибах. Ученые предполагают, что в природе есть еще много других молекул типа "молекулярный клей", которые еще не обнаружены наукой. Исследователи предположили, что эти два вещества могут обладать свойствами молекулярного клея, поскольку у них существует сразу несколько электрофильных сайтов связывания, которые могут участвовать в поликовалентных взаимодействиях с заряженными аминокислотными остатками белков человека, превращая тем самым определенные белки в новые функциональные комплексы, несуществующие в природе.
Было показано, что асукамицин и манумицин связываются с белком UBR7, в результате чего такой комплекс непосредственно связывается с TP53. Затем в присутствии комплекса UBR7-асукомицин-TP53 происходит активация транскрипции p53. Однако, все же точные механизмы, лежащие в основе данного явления остались невыявленными. Однако авторы предполагают, что комплекс UBR7-асукомицин действует как шаперон, который увеличивает термостабильность TP53, тем самым, вероятно, повышая его способность связываться с ДНК и активировать транскрипционную активность TP53. Такой эффект позволил подавить пролиферацию тройного негативного рака молочной железы – особенно агрессивной формы рака данной группы онкологических заболеваний.