


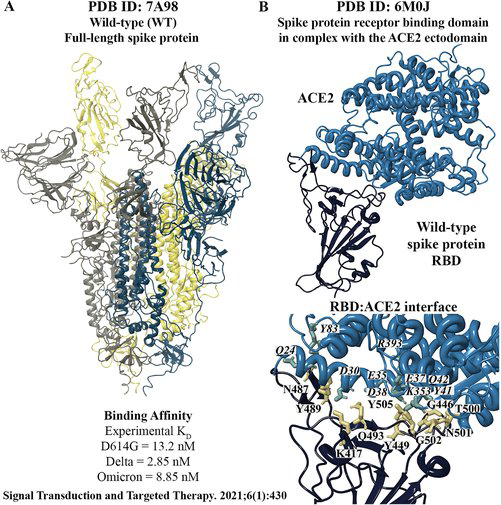
С начала пандемии продолжают появляться новые штаммы SARS-CoV-2, адаптирующиеся к человеческой популяции. В данный момент штамм омикрон, состоящий из нескольких подвидов, является доминирующим вариантом вируса во всем мире. При проникновении SARS-CoV-2 в клетку происходит взаимодействие спайкового белка вируса с ангиотензинпревращающим ферментом 2 (ACE2), который в этом случае выполняет роль рецептора. Мутации в спайковом белке могут привести к физико-химическим и структурным изменениям, влияющим на связывание и взаимодействие с ACE2, а также на эффективность нейтрализующих антител.
Ученые из Австралии исследовали параметры связывания спайкового белка ряда штаммов SARS-CoV-2 с ACE2, который является рецептором и точкой входа в клетку коронавирусов. С помощью методов молекулярного моделирования, в частности различных вариантов анализа интерфейса взаимодействия двух белков, было выявлено, что спайковый белок штаммов дельта и омикрон связывается с рецептором ACE2 более эффективно по сравнению с исходным вариантом вируса. Также были показаны конкретные аминокислотные остатки и мутации, играющие важную роль в связывании вируса с рецептором. Стоит отметить две мутации – G496S и Q493R, – которые усилили связывание SARS-CoV-2 в штамме омикрон, который образует с ACE2 комплекс, структурно отличающийся от штамма дельта и исходного варианта вируса.
Полученные в ходе проведенного исследования результаты не противоречат уже существующим экспериментальным данным, а предложенный подход не является ресурсо- и времязатратным, поэтому использование такого протокола видится перспективной стратегией предсказания вирулентности новых
штаммов.
Первоисточник:
Eleni Pitsillou, Julia J.Liang, Raymond C.Beh, Andrew Hung, Tom C.Karagiannis, Molecular dynamics simulations highlight the altered binding landscape at the spike-ACE2 interface between the Delta and Omicron variants compared to the SARS-CoV-2 original strain, Computers in Biology and Medicine, № 149/DOI: 10.1016/j.compbiomed.2022.106035