


Ингибиторы рецепторных тирозинкиназ (RTK) в последнее время получили широкое распространение в качестве первой линии лечения пациентов с некоторыми типами рака, в которых наблюдается активация RTK вследствие их гиперэкспрессии или соматических мутаций. Несмотря на высокую клиническую эффективность препаратов, продолжительность ответа часто ограничена в силу развития устойчивости к терапии. Ответ клеток на воздействие лекарства значительно варьирует в пределах клональной клеточной популяции, а развивающаяся устойчивость может быть не ассоциирована с известными молекулярными механизмами. Поиск новых механизмов развития резистентности остается актуальным.
STK11(LKB1) является четвертым по частоте мутаций геном при аденокарциноме легкого. Потеря функции STK11 встречается в 30% случаев этого заболевания и ассоциирована с устойчивостью к иммунотерапии ингибиторами контрольных точек. Каким образом потеря функции STK11 изменяет свойства опухолевых клеток оставалось недостаточно изученным.
Белок KEAP1 является молекулярным сенсором окислительного стресса. КЕАР1 регулирует транспорт мастер регулятора NRF2 в ядро, который индуцирует экспрессию генов, кодирующих ферменты детоксикации. Среди них есть транспортер цистина/глутамата (SLC7A11), который экспрессируется во многих опухолях с KEAP1-мутантным фенотипом.
Технология направленной деградации белков (НДБ) является новым перспективным направлением биотехнологии, включая разработку лекарственных препаратов. В отличие от других подходов данная технология позволяет воздействовать на мишени, недоступные для низкомолекулярных ингибиторов или моноклональных антител.
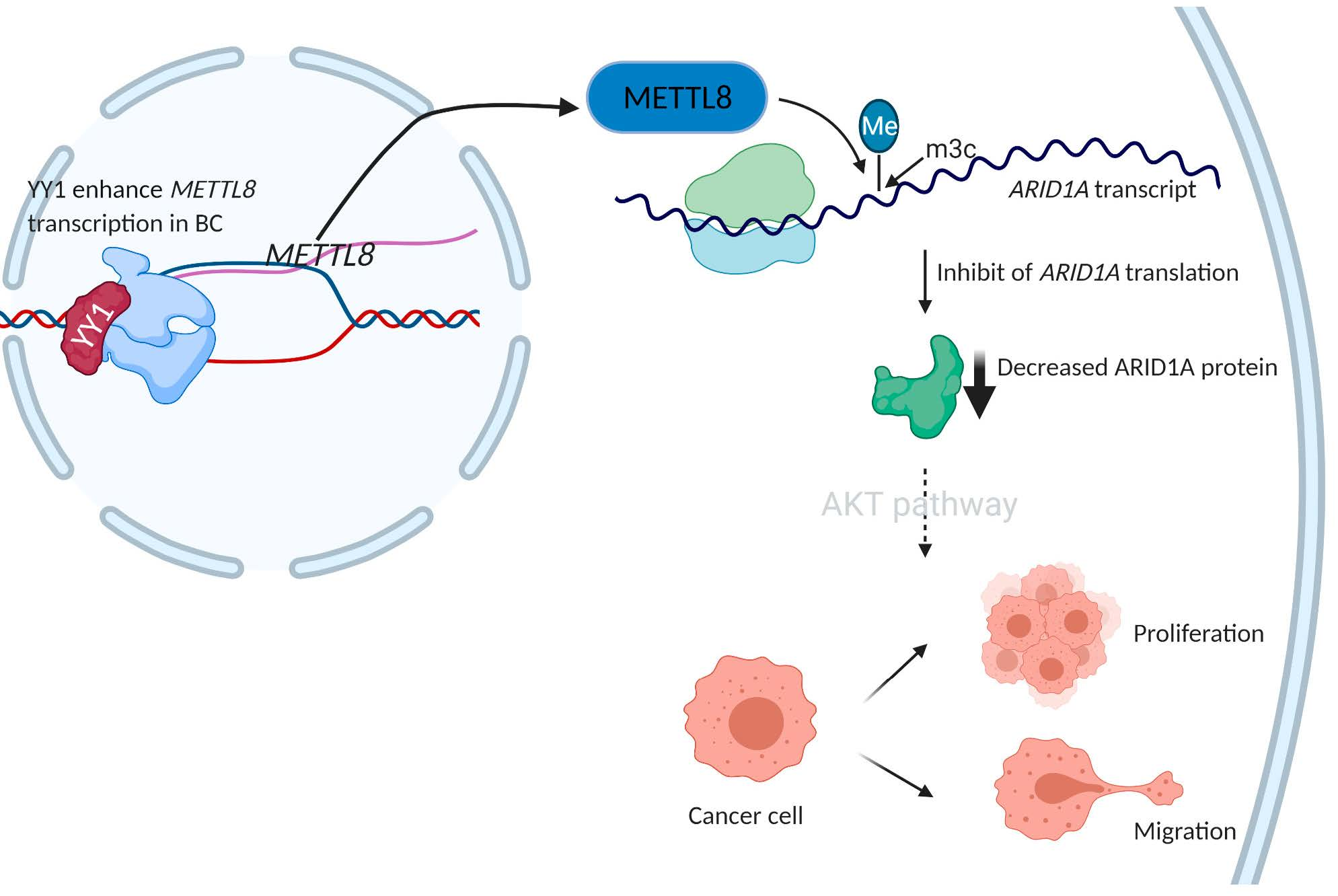
Недавно ученые установили ассоциации между ковалентными модификациями оснований мРНК и онкогенезом. Так, одна из самых распространенных модификаций мРНК представляет собой метилирование пуриновых и пиримидиновых оснований, катализируемое мРНК-метилтрансферазой. Данное исследование посвящено выяснению роли молекулярного механизма, опосредованного одной из изоформ мРНК-метилтрансферазы, в прогрессии рака молочной железы (РМЖ).